著者:
Alice Brown
作成日:
25 5月 2021
更新日:
15 5月 2024

コンテンツ
質量パーセントは、化合物を形成する各元素のパーセンテージを決定します。この値を見つけるには、グラム/モル単位の化合物元素のモル質量、または溶液の作成に使用されたグラム数が必要になります。質量パーセントは、元素(または溶質)の質量を化合物(または溶液)の質量で割る基本式を使用して簡単に計算できます。
ステップ
2の方法1/2:与えられた質量でパーセンテージ質量を見つける
- 化合物の質量パーセントの方程式を定義します。 化合物の基本式は次のとおりです。パーセント質量=()x100。値をパーセンテージで表すには、最後に結果に100を掛ける必要があります。
- 関心のある化合物の質量は、問題で与えられた質量です。この値が指定されていない場合は、次の方法を参照して、質量が指定されていない場合の質量のパーセンテージを見つける方法を学習してください。
- 化合物の総質量は、化合物または溶液の作成に使用されたすべての元素の質量を加算することによって計算されます。
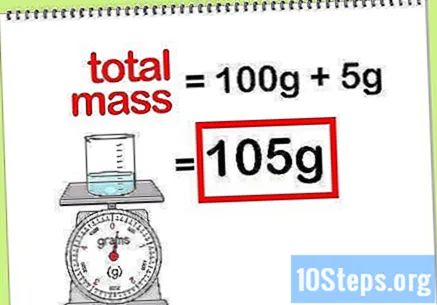
化合物の総質量を計算します。 追加されるすべての元素または化合物の質量値がわかっている場合は、それらを合計して、化合物または最終溶液の質量を計算する必要があります。この値は、質量パーセントの計算における分母になります。- 例えば: 100gの水に溶解した5gの水酸化ナトリウムの質量パーセントはどれくらいですか?
- 化合物の総質量は、過酸化ナトリウムの量に水の量を加えたものです:100 g + 5 g、合計で105gの質量。

問題の化学物質の質量を特定します。 あなたが見つける必要があるとき 質量パーセント、問題は、特定の要素(問題の要素)の質量をすべての要素の総質量のパーセンテージとして見つけることを求めています。問題の要素の質量に注意してください。この値は、質量パーセントの計算における分子になります。- たとえば、元素の質量は5gの水酸化ナトリウムです。
- パーセント質量式の変数を代入します。 各変数の値を決定した後、方程式でそれらを置き換えます。
- 例:質量パーセント=()x 100 =()x100。

質量パーセントを計算します。 方程式が作成されたので、それを解いて質量パーセントを計算します。元素の質量を化合物の総質量で割り、100を掛けます。結果は、化学元素の質量パーセントになります。- 例:()x 100 = 0.04761 x 100 = 4.751%。したがって、100gの水に溶解した5gの水酸化ナトリウムの質量パーセントは4.751%です。
方法2/2:質量が指定されていない質量のパーセンテージを見つける
- 化合物の質量パーセントの方程式を定義します。 化合物の質量パーセントの基本式は次のとおりです。質量パーセント=()x100。値をパーセンテージで表すには、最後に結果に100を掛ける必要があります。
- 質量値がわからない場合は、モル質量を使用して化合物の元素の質量パーセントを見つけることができます。
- 例えば: 水分子中の水素の質量パーセントはいくつですか?.
書きます 化学式. 各化合物の化学式が提供されていない場合は、それらを書き留める必要があります。それ以外の場合は、ステップ「各元素の質量を見つける」にスキップします。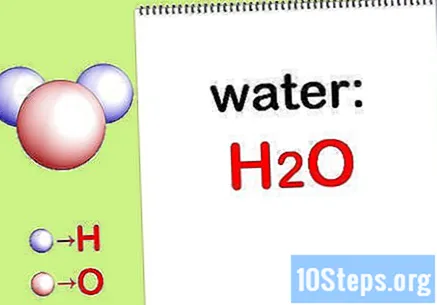
- たとえば、水の化学式を書きます:H2THE。
化合物の各元素の質量を求めます。 周期表を参照して、化学式の各元素の分子量を探します。一般に、元素の質量は化学元素記号の下にあります。化合物の各元素の質量に注意してください。
- たとえば、酸素の分子量は15.9994で、水素の分子量は1.0079です。
質量にモル比を掛けます。 化合物に含まれる各元素のモル数を特定します。モル数は、サブスクライブされた化合物の数によって与えられます。各元素の分子量にモル比を掛けます。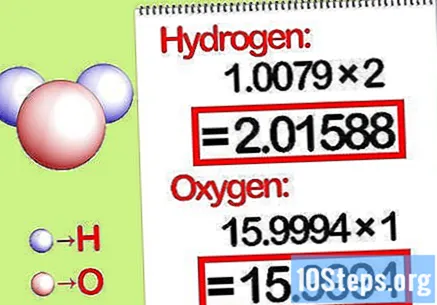
- たとえば、水中の水素と酸素のモル比は2:1です。したがって、水素の分子量に2を掛けて(1.00794 X 2 = 2.01588)、酸素の分子量をそのままにします(15.9994)。
化合物の総質量を計算します。 化合物のすべての元素の総質量を追加します。モル比で計算された質量を使用して、化合物の総質量を計算することができます。この数値は、パーセント質量方程式の分母になります。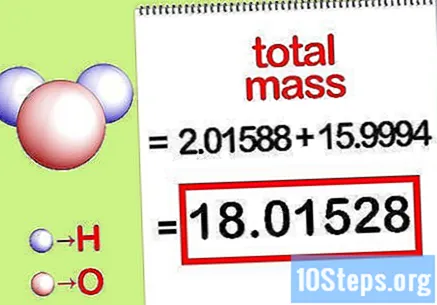
- たとえば、2.01588 g / mol(水素原子の2モルの質量)と15.9994 g / mol(酸素原子の1モルの質量)を加算すると、18.01528 g / molになります。
問題の要素の質量を特定します。 あなたが見つける必要があるとき 質量パーセント、問題では、化合物内の特定の元素の質量を、すべての元素の総質量のパーセンテージとして見つける必要があります。問題の要素の質量を特定し、それを書き留めます。モル比を使用して計算された質量値です。この値は、パーセント質量方程式の分子です。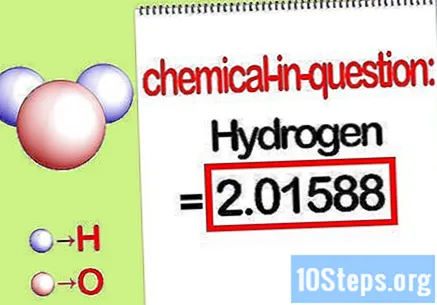
- たとえば、化合物の水素質量は2.01588 g / mol(2モルの水素原子の質量)です。
- 質量パーセント式の変数を代入します。 各変数の値を決定した後、最初のステップで定義された方程式でそれらを置き換えます:パーセント質量=()x100。
- 例:質量パーセント=()x 100 =()x100。
質量パーセントを計算します。 方程式が作成されたので、それを解いて質量パーセントを計算します。元素の質量を化合物の総質量で割り、100を掛けます。結果は、化学元素の質量パーセントになります。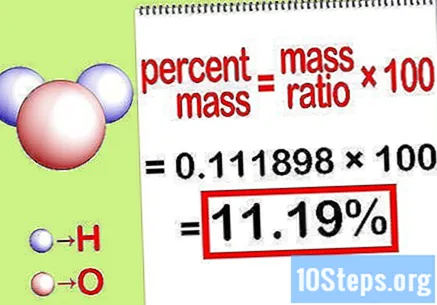
- たとえば、質量パーセント=()x 100 = 0.111189 x 100 = 11.18%。したがって、水分子中の水素原子の質量パーセントは11.18%です。