コンテンツ
この記事の内容:高速ルールを使用するKsp9参照の溶解度を計算する
溶解度は、未溶解の粒子を残さずに液体に完全に溶解する固体化合物の特性を表すために化学で使用される用語です。イオン性化合物(帯電)のみが可溶性です。実際的な問題を解決するには、いくつかの原則を記憶するか、溶解度規則の表を使用する必要があります。これは、ほとんどのイオン化合物が水に加えられたときに溶解するかどうかを知るのに役立ちます。実際、変化に気付かなくても、一部の分子は溶解します。したがって、より高いレベルの精度が必要な実験の場合、計算方法を使用する必要があります。
ステージ
パート1クイックルールを使用する
- イオン化合物の詳細。 各原子には、一定量の電子が含まれています。ただし、原子が1つまたは複数の電子を引き付けたり失ったりする場合があります。彼はこうして イオンつまり、帯電した化学種です。負に帯電したイオン(1つまたは複数の追加の電子を持つ)が正に帯電したイオン(1つまたは複数の電子を失った)に関連付けられると、磁石の反対の帯電極が満たされるのと同じように、結合が形成されます。これにより、イオン性化合物が作成されます。
- 負電荷を持つイオンは呼ばれます アニオン プラスに帯電している人は カチオン.
- 通常の原子には同じ数の陽子と電子が含まれているため、電荷を中和することができます。
-
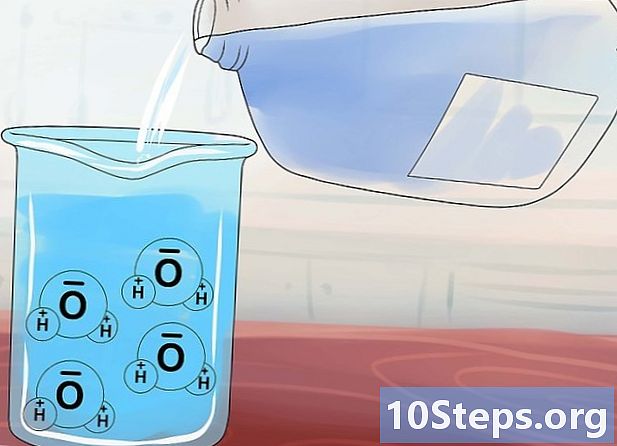
溶解度の概念を理解します。 水分子(H2O)異常な構造を持ち、正の端と負の端を持つという点で磁石に似ています。イオン性化合物を水に追加すると、これらの「液体磁石」が化合物の周囲に引き寄せられ、アニオンとカチオンを分離しようとします。- 化学結合が十分に強くないイオン化合物は 可溶水分子は簡単に分離して溶解できるためです。対照的に、より強い結合を持つ化合物はより耐性があり、 不溶性水の分子がそれらを分離できないためです。
- これらの化合物のいくつかの内部結合は、それらの上の水によって発揮されるものと同様の強度を持っています。これらの化合物は わずかに溶けるかなりの部分が水に溶け、残りは結合しているためです。
-

溶解度のルールを学びます。 原子間の相互作用はかなり複雑であるため、化合物の溶解度を決定することは必ずしも容易ではありません。化合物の最初のイオンを観察して、通常の反応を確認し、例外をチェックして、特定の方法で反応しないことを確認します。- たとえば、塩化ストロンチウム(SrCl2)可溶性かどうか、ライオンSrまたはClの挙動を観察します。Clは 一般的に可溶性、塩素がルールの例外であるかどうかを確認します。 Srは例外ではありません。つまり、SrCl2 可溶性化合物です。
- 各ルールの主な例外を以下に説明します。他の例外もありますが、それらは化学クラスまたは実験室での経験中にのみ会います。
-

化合物がアルカリ金属を含む場合、化合物は可溶性であることに注意してください。 これらには、Li、Na、K、Rb、およびCsが含まれます。これらの金属は、グループ1(IA)元素のリストに含まれています。これらには、リチウム、ナトリウム、カリウム、ルビジウム、セシウムが含まれます。これらの元素のいずれかを含むほとんどすべてのイオン性化合物は可溶性です。- 例外: リー3PO4 不溶性です。
-
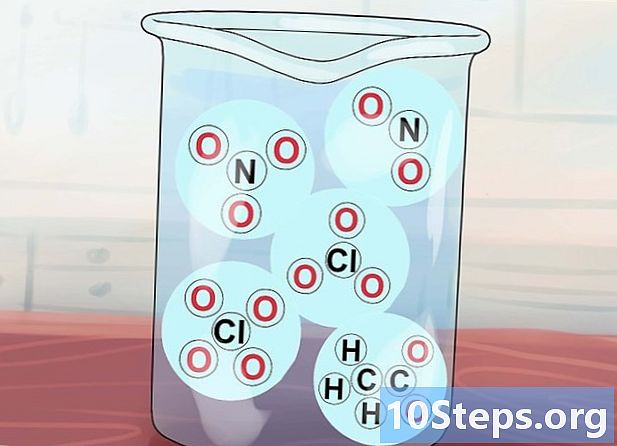
他の可溶性化合物を知る。 NO化合物であることを知っている3、C2H3O2、いいえ2、ClO3 またはClO4 可溶性です。これらは、それぞれ硝酸イオン、酢酸イオン、亜硝酸イオン、塩素酸イオン、過塩素酸イオンです。酢酸塩はしばしばOACと略されることに注意してください。- 例外: Ag(OAc)(酢酸銀)およびHg(OAc)2 (酢酸水銀)は不溶性です。
- 硝酸銀2 およびKClO4 わずかに溶けます。
-

Cl、Br、I化合物はしばしば可溶性であることに注意してください。 塩化物、臭化物、およびヨウ化物イオンは、ハロゲン化塩と呼ばれるほとんど常に可溶性の化合物を形成します。- 例外: これらのイオンの1つとイオンAg(銀)、Hgとの組み合わせ2 (水銀)またはPb(鉛)は不溶性化合物を生成します。これは、Cu(銅)およびTl(タリウム)イオンから得られるあまり一般的でない化合物にも適用されます。
-

SOを含む化合物4 通常可溶性です。 通常、ライオンの硫酸塩は可溶性化合物を形成しますが、いくつかの例外があります。- 例外: 硫酸ライオンは、Sr(ストロンチウム)、Ba(バリウム)、Pb(鉛)、Ag(銀)、Ca(カルシウム)、Ra(ラジウム)、Agの不溶性化合物を生成します2 (二原子銀)。硫酸銀と硫酸カルシウムは、わずかに溶解する化合物と見なされるのに十分なだけ溶解することを覚えておいてください。
-

OHまたはSを含む化合物は不溶性であることに注意してください。 それらはそれぞれ水酸化物と硫化物です。- 例外: アルカリ金属(グループIA元素)とそれらがどのように可溶性化合物を形成するかを覚えていますかLi、Na、K、Rb、およびCsはすべて、水酸化物および硫化物と可溶性化合物を形成するイオンです。さらに、水酸化物はアルカリ土類金属(第2グループの化学元素)と可溶性塩を形成します:Ca(カルシウム)、Sr(ストロンチウム)およびBa(バリウム)。ヒドロキシルとアルカリ土類金属間の結合から生じる化合物は、コンパクトなままであり、時にはわずかに可溶性の化合物と見なされる十分な分子を持っています。
-

COを含む化合物3 またはPO4 不溶性です。 これらはそれぞれ炭酸塩とリン酸塩のライオンであり、これらの化合物に何を期待するかを知っておく必要があります。- 例外: これらのイオンは、アルカリ金属(Li、Na、K、Rb、Cs)およびアンモニウムライオンNHと可溶性化合物を形成します。4.
パート2 Kの溶解度を計算するSP
-

溶解度積定数Kを探しますSP. これは化合物ごとに異なる定数であるため、テーブルまたはオンラインで検索する必要があります。溶解度積Kspは実験的に決定されるため、使用しているチャートによって大きく異なる場合があります。そのため、化学ブックを参照するのが最適です。特に明記しない限り、ほとんどの表には、25°Cでのいくつかの固体のKsp値が示されています。- たとえば、ヨウ化鉛(PbI2)、溶解度定数に注意してください。このテーブルを使用する場合は、7.1×10を使用する必要があります。
-

化学式を書きます。 まず、化学種が溶解したときにイオンにどのように分解するかを判断し、一方の定数Kを取得して方程式を書きますSP 反対側の構成イオン。- たとえば、PbI分子2 これらはPb、I、Iイオンに分解されますが、化合物の電荷は中性であるため、一方のイオンの電荷を知るだけで他方の電荷を計算できます。
- 次のように方程式を書きます:7.1×10 =。
- この式は、化学物質の溶解度定数に関連しています。溶解度積の表で見つけることができます。 2個のIイオンがあるため、この要素を2乗する必要があります。
-

変数を使用するように方程式を再定式化します。 関係する分子とディオンの数を使用して、方程式をあたかも単純な代数問題であるかのように書き換えます。これを行うには、xが溶解する化合物の量に等しいと仮定し、xに依存するように各イオンの量を表す変数を再配置します。- この例では、7.1×10 =として書き換える必要があります。
- 化合物には鉛イオン(Pb)が含まれているため、溶解分子の数は遊離鉛イオンの数と等しくなければなりません。したがって、= x。
- 鉛イオンごとに2つのダイオードイオン(I)があるため、ダイオードのダトメ数は2倍に等しいと言えます。
- 方程式は、7.1×10 =(x)(2x)になります。
-

もしあれば、普通の原子を考えてください。 化合物を純水に溶解しようとしている場合は、この手順を無視してください。ただし、化合物が1つ以上の構成イオン(「共通イオン」)を含む溶液に溶解すると、溶質の溶解度が大幅に低下します。この効果は、主に不溶性の化合物では特に重要であり、これらの場合、平衡状態にあるイオンの大部分は溶液中に存在するイオンに由来すると仮定できます。方程式を書き換えて、溶液中に存在するイオンの未知のモル濃度(mol / lまたはM)を含めます。これを行うには、このイオンに使用されるx値を置き換えます。- たとえば、ヨウ化鉛化合物が0.2 M塩化鉛(PbCl2)、方程式は次のようになります:7.1×10 =(0.2 M + x)(2x)。次に、0.2 Mの濃度はxの値よりも大幅に大きいため、方程式は次のようにさらに書き換えることができます:7.1×10 =(0.2 M)(2x)。
-

方程式を解いてみてください。 xの値を見つけて、化合物の溶解度を計算します。答えは、水1リットルあたりの溶解化合物のモル数で表されます。これは、溶解度定数の定義方法によるものです。したがって、最終結果を見つけるために計算機が必要になる場合があります。- 次の式は、一般的なイオンを含む溶液ではなく、純水への化合物の溶解度に適用されます。
- 7.1×10 =(x)(2x)。
- 7.1×10 =(x)(4x)。
- 7.1×10 = 4倍。
- (7.1×10)÷4 = x。
- x =∛((7.1×10)÷4)。
- x = 1リットルあたり1.2 x 10モル。溶解するモルの量です。微量であるため、化合物は不溶性であると言えます。

- (Kの値をグループ化するテーブルSP)さまざまな固体用
- 溶解した化合物の量に関する実験データがある場合、同じ式を使用して溶解度定数Kを見つけることができます。SP .
- これらの用語の一般に認められた定義はありませんが、化学者はほとんどの化合物を犠牲にしています。かなりの量の溶解分子と非溶解分子を含む一部の化合物は、溶解度表で異なる方法で説明できます。
- アンモニア(NH4OH)可溶性化合物として、これはエラーです。少量のNHディオン4 およびOHは検出できますが、それらを分離して化合物を形成することはできません。